Лекция № 1. Предмет и содержание курса ОХТ
Слово «технология» греческого происхождения и имеет дословный перевод «наука о ремесле». С современной точки зрения мы можем определить технологию как науку о способах массового производства продукта.
Технологии бывают механические и химические. Механическая технология изучает процессы, связанные с изменением формы и физических свойств перерабатываемого сырья главным образом, путем механических операций. Например, изготовление изделий из древесины – деревообрабатывающие технологии, изготовление изделий из металла – машиностроение и т.д. Химическая технология изучает процессы, связанные с изменением состава и химических свойств перерабатываемого сырья за счет протекания химических реакций.
Существует великое множество частных химических технологий, которые можно объединить в две большие группы:
|
химические технологии
|
|
неорганические
|
органические
|
|
1) основной неорганический синтез – производство кислот щелочей, солей и минеральных удобрений;
2) тонкий неорганический синтез – производство препаратов, реактивов, лекарственных препаратов, редких металлов и т.д.;
3) металлургия –
производство черных и цветных металлов;
4) силикатные производства –
производство вяжущих веществ, керамики и стекла;
5)ядерно-химическая технология.
|
1) основной органический синтез –
крупнотоннажное производство органических продуктов;
2) тонкий органический синтез –
производство реактивов, лекарств, средств защиты растений и т.д.;
3) переработка нефти и газов;
4) нефтехимический синтез –
производство органических продуктов на основе углеводородного сырья;
5) переработка растительного и животного сырья;
6) высокомолекулярные технологии –
производство синтетического каучука, пластмасс, химических волокон и других высокомолекулярных соединений;
7) биотехнологии –
производство кормовых дрожжей, аминокислот, ферментов, антибиотиков и т.д.
|
| |
|
При разработке любой частной технологии нужно знать три общеинженерные дисциплины: общую химическую технологию (ОХТ), процессы и аппараты химической технологии (ПАХТ) и промышленную теплотехнику (ПТ), которые вместе составляют основу промышленной химии.
|
частные химические технологии
|
|
Промышленная химия
|
|
ОХТ
|
ПАХТ
|
ПТ
|
| |
|
|
Общая химическая технология – наука, изучающая теоретические основы разработки технологий для различных классов химических реакций.
Предмет изучения ОХТ – закономерности, лежащие в основе функционирования химического производства.
Задачи ОХТ как науки:
1) отыскание общих закономерностей протекания химико-технологических процессов;
2) на основе знания общих закономерностей нахождение оптимальных условий ведения химико-технологических процессов;
3) изучение химических превращений с учетом массо- и теплообменных процессов;
4) повышение эффективности использования сырья, энергии, снижение количества отходов и выбросов в окружающую среду; повышение качества выпускаемой продукции.
Методы ОХТ:
- экспериментальный;
- моделирование.
Основные понятия химической технологии
Химическое производство – совокупность процессов и операций, осуществляемых в машинах и аппаратах и предназначенных для переработки сырья путем химических превращений в необходимый продукт.
Химико-технологический процесс (ХТП) – часть химического производства, состоящая из трех основных стадий:

Целевой продукт – продукт, ради которого организован данный ХТП. Все остальные продукты называют побочными. Побочные продукты могут получаться как в целевой, так и в побочных реакциях. Если побочный продукт не находит применения, его называют отбросом; если он используется, то его называют отходом или вторичным сырьем. Если целевой продукт используется в качестве исходного материала в другом производстве, то он называется полупродуктом.
Исходный материал, поступающий на переработку и обладающий стоимостью, называют сырьем. Вещество, принимающее непосредственное участие в целевой химической реакции, называется реагентом. Реагент – это главный, но не единственный компонент сырья. Все компоненты сырья, которые не участвуют в целевой реакции, называют, обычно, примесями.
В технологии часто пользуются понятиями «превращенный» и «непревращенный» реагент. Превращенный реагент – это то количество реагента, которое вступило в реакции (как целевые, так и побочные). Непревращенный реагент – это то количество реагента, которое выходит из реактора в непревращенном, первоначальном состоянии. Сумма масс превращенного и непревращенного реагента равна массе поданного в реактор реагента.
Вспомогательные материалы – химические вещества, которые обеспечивают нормальное протекание ХТП (катализаторы, растворители и др.).
Исходная смесь – смесь веществ, поступающих в реактор, на стадию химического превращения. Реакционная смесь – смесь веществ, находящихся в реакторе или выгружаемых из него. Ее состав меняется в процессе реакции. Мы можем говорить о составе реакционной смеси в определенный момент времени от начала реакции.
Пример:
4NH3 + 5O2 → 4NO + 6H2O
4NH3 + 3O2 → 2N2 + 6H2O
4NH3 + 4O2 → 2N2O + 6H2O
Первая реакция является целевой, две другие – побочные. Оксид азота (II) – NO –целевой продукт на стадии окисления аммиака и полупродукт в производстве азотной кислоты. Вода, азот и оксид азота (I) – побочные продукты. Реагентами в этом процессе являются аммиак и кислород; сырьем – аммиак, содержащий некоторое количество примесей, и воздух, в котором примесями являются азот и другие газы. Вспомогательным материалом является платина, используемая в процессе в качестве селективного катализатора, ускоряющего только первую реакцию. Исходная смесь представляет собой аммиачно-воздушную смесь с содержанием аммиака 9,5 – 11,5 % об. Реакционная смесь – нитрозные газы, содержащие NO, N2O, N2, пары H2O, а также непревращенные О2 и NН3.
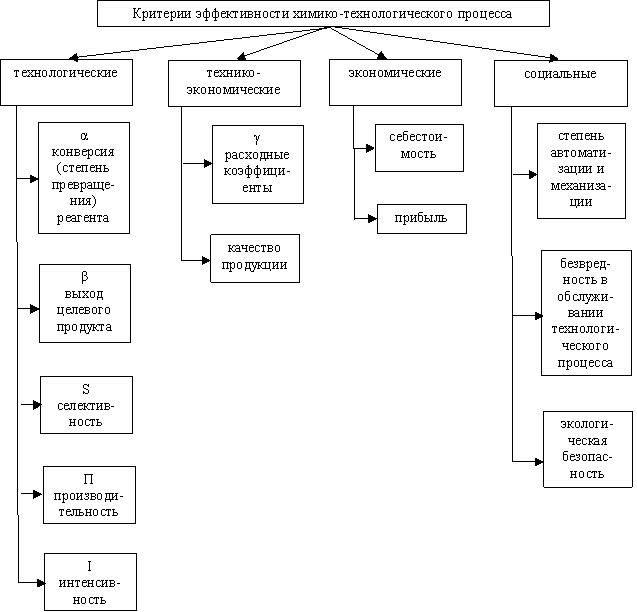
Анализ эффективности проведения ХТП
Для оценки эффективности проведения ХТП служат ряд показателей, которые можно объединить в четыре группы.
Об эффективности химического производства в целом судят, прежде всего, по экономическим показателям. Одним из самых значимых экономических показателей является себестоимость, то есть затраты предприятия в денежном выражении, связанные с производством единицы химического продукта. Разница между ценой и себестоимостью продукта, умноженная на объем производства составляет прибыль производителя. Снижение себестоимости продукции является чрезвычайно важной задачей для химика-технолога как производителя химического продукта. Для оценки целесообразности и эффективности различных путей снижения себестоимости продукта оценим вклад затрат различного вида в общую сумму затрат на его производство.
|
№
|
Вид затрат
|
% от себестоимости
|
|
1
|
Сырье и материалы
|
70
|
|
2
|
Энергия
|
10 - 20
|
|
3
|
Амортизационные отчисления
|
3 - 4
|
|
4
|
Заплата основных и вспомогательных рабочих
|
3 - 4
|
|
5
|
Цеховые расходы
|
1
|
|
6
|
Общезаводские расходы
|
1
|
|
7
|
Транспортные расходы
|
1
|
Из проведенного сравнения можно сделать вывод, что наиболее эффективными путями снижения себестоимости является рациональное использование сырья и уменьшение энергоемкости производства.
При оценке эффективности химического производства большое значение имеют также социальные критерии, показывающие степень безопасности производства для людей и окружающей природы.
При определении эффективности отдельных этапов процесса производства химического продукта пользуются технологическими и технико-экономическими показателями.
Конверсия, выход целевого продукта и селективность с разных сторон характеризуют эффективность проведения конкретной химической реакции:
- величина « α » показывает полноту использования сырья;
- величина « β » характеризует полученное количество целевого продукта, как долю от максимально возможного в этих условиях проведения реакции;
- величина « S » оценивает долю реагента, пошедшего на целевую реакцию.
Наиболее обобщенным показателем является выход целевого продукта. Его величина зависит от «α» и «S».
Для простых реакций S = 100% и α = β.
Для сложных реакций, когда наряду с целевой реакцией протекают побочные реакции, S < 100% и α ≠ β.
Производительность и интенсивность характеризуют эффективность работы отдельных аппаратов. Величина этих показателей определяется эффективностью использования возможностей, как самой химической реакции, так и реактора, в котором она проводится. Производительность и интенсивность в обобщенном виде содержат величины выхода целевого продукта и средней скорости процесса.
Конверсия (степень превращения) реагента рассчитывается по формуле:
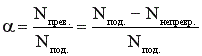 , (1)
, (1)
где Nпод., Nпрев., Nнепревр. – соответственно количество поданного, превращенного и непревращенного реагента. Эти величины можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Степень превращения выражают в долях или в процентах; в последнем случае выражение (1) для расчета α умножают на 100.
Часто, особенно в непрерывных процессах, конверсию рассчитывают через концентрацию реагента в исходной и реакционной смеси:
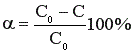 , (2)
, (2)
где С0 –концентрация реагента в исходной смеси, С – концентрация реагента в реакционной смеси. Выражение (2) справедливо лишь в том случае, когда реакция протекает без изменения объема реакционной смеси.
Изменение объема реакционной смеси в процессе реакции можно учесть с помощью коэффициента изменения объема ε.
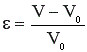 , (3)
, (3)
где V0 – начальный объем, V- объем реакционной смеси к определенному моменту времени. Величина ε является положительной при увеличении объема смеси во время реакции и отрицательной при его уменьшении.
Изменение объема при жидкофазных процессах происходит, например, при поглощении какого-либо газа жидкостью или при разложении жидкого вещества с образованием летучих продуктов. Для газофазных процессов изменение объема обычно происходит из-за изменения числа молей веществ во время реакции. В последнем случае ε зависит от начального и конечного числа молей смеси.
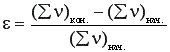 . (4)
. (4)
Если реагенты взяты в стехиометрическом соотношении и в реакционной смеси отсутствует разбавитель, то для реакции aA + bB → rR +sS коэффициент изменения объема «ε» равен
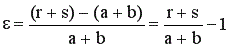 . (5)
. (5)
При избытке одного из реагентов или при наличии в реакционной смеси разбавителя (инертного газа) «ε» рассчитывается по формуле:
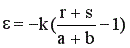 , (6)
, (6)
где k – доля стехиометрической смеси исходных реагентов в реакционной смеси. Для стехиометрической смеси k = 1.
С учетом коэффициента изменения объема реакционной смеси конверсия реагентов рассчитывается по формуле (7).
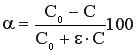 (7)
(7)
Степень превращения реагентов в реакторе изменяется во времени от нуля до некоторой максимальной величины. В необратимых процессах максимальное значение конверсии равно 100%, т.е. все количество реагентов может превратиться в продукты. Пределом протекания обратимой реакции является достижение равновесного состояния системы, при котором скорость прямой и обратной реакции равны, а состав реакционной смеси остается постоянным во времени. Степень превращения реагентов, достигаемая к этому моменту, называется равновесной конверсией (*) и является максимальной для данного процесса при определенных условиях его проведения.
Селективность (избирательность, избирательная конверсия) используется для характеристики сложных процессов, в которых наряду с целевой реакцией протекают побочные реакции.
Полная (интегральная) селективность 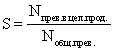 , (8)
, (8)
где 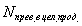 - количество реагента, пошедшее на образование целевого продукта; N общ. прев. – общее количество превращенного реагента.
- количество реагента, пошедшее на образование целевого продукта; N общ. прев. – общее количество превращенного реагента.
Эти величины можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Полную селективность выражают в долях или процентах; в последнем случае выражение (8) умножают на 100.
Мгновенная (дифференциальная) селективность 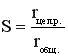 , (4)
, (4)
где rцел.р. – скорость расходования реагента по целевой реакции; rобщ. – суммарная скорость расходования реагента. Понятие мгновенной селективности имеет смысл только для сложных параллельных реакций.
Если в процессе химической реакции объем реакционной смеси не изменяется (V=const), то селективность можно рассчитывать, используя концентрацию реагента и целевого продукта в реакционной смеси. Например, для реакции aA + bB → rR +sS , где R - целевой продукт
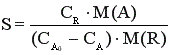 , (9)
, (9)
где М(А), М(R) – молярные массы, 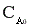 и СА – начальная и текущая концентрация реагента, СR – концентрация целевого продукта.
и СА – начальная и текущая концентрация реагента, СR – концентрация целевого продукта.
Выход целевого продукта – это отношение реально полученного количества продукта (Nфакт.) к максимально возможному его количеству (Nmax), которое могло быть получено при данных условиях осуществления химической реакции.
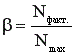 (10)
(10)
Nфакт. и Nmax можно задавать в единицах количества вещества (моль, кмоль) или в единицах массы (г, кг и др.). Выход выражают в долях или процентах; в последнем случае выражение (10) умножают на 100. Расчет величины β зависит от типа химической реакции.
В случае необратимой реакции величину Nmax (в молях) рассчитывают по уравнению реакции: aA + bB → rR +sS , где R – целевой продукт
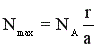 (11)
(11)
Если NА – количество подаваемого в реактор реагента, полученное значение Nmax является максимально возможным для этой реакции, а рассчитанный по уравнению (10) выход называют выходом на поданный реагент А. Если NА – количество превращенного реагента, то рассчитанная по уравнению (10) величина называется выходом на превращенный реагент А.
В случае обратимой химической реакции пользуются понятием «равновесный выход» - β*.
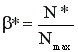 , (12)
, (12)
где N* - количество продукта, образовавшегося к моменту достижения химического равновесия; Nmax – максимальное количество продукта, которое может образоваться по данной реакции при условии, что поданный реагент полностью превращается в целевой продукт. Равновесный выход характеризует степень смещения равновесия в сторону образования целевого продукта.
Отношение 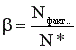 (13), где Nфакт. – фактически полученное количество продукта, показывает степень достижения равновесия.
(13), где Nфакт. – фактически полученное количество продукта, показывает степень достижения равновесия.
Расчет селективности и выхода продукта можно проводить по любому из реагентов; обычно выбирают тот реагент, который взят в недостатке, или наиболее дорогостоящий реагент.
Производительность – количество целевого продукта, производимое в единицу времени.
Интенсивность – количество целевого продукта, производимое в единицу времени с единицы объема реактора или с единицы поверхности катализатора.
Пропускная способность установки – количество сырья, пропускаемое через установку в единицу времени.
Расходный коэффициент по сырью - это масса сырья, которая расходуется на получение единицы массы целевого продукта.
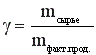 (г/г, кг/кг, т/т и др.) (14)
(г/г, кг/кг, т/т и др.) (14)
Расходный коэффициент рассчитывается по таблице материального баланса; он всегда больше теоретического расходного коэффициента, который рассчитывают по уравнению реакции:
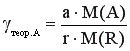 (15)
(15)
Качество продукции – совокупность свойств целевого продукта, обуславливающих его пригодность удовлетворять определенные потребности в соответствии с его назначением.
Качество химического продукта зависит от качества исходного сырья и материалов, уровня развития науки и техники, прогрессивности применяемой технологии, организации труда и производства, квалификации кадров и регулируется различными нормативными документами:
ГОСТ – государственный стандарт,
ОСТ – отраслевой стандарт,
РСТ – республиканский стандарт,
СТП – стандарт предприятия,
ТУ – технические условия.