Лекция № 5. Закономерности управления химико-технологическими процессами
Управлять ХТП – это означает, меняя технологические параметры процесса (температуру, давление, состав сырья, катализатор, скорость перемешивания, конструкцию реактора, схему соединению реакторов и т.д.) добиваться максимальной эффективности процесса. Для этого нужно знать функциональную зависимость выбранного критерия эффективности от величины технологических параметров. Изучением этих зависимостей и занимается наука ОХТ.
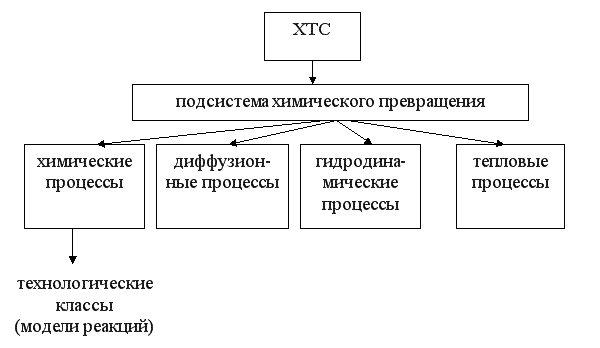
При изучении общих закономерностей мы используем метод декомпозиции, то есть рассмотрим особенности функционирования отдельных подсистем ХТС. Главной подсистемой ХТС является подсистема химического превращения. В подсистеме химического превращения происходит превращение исходных реагентов в продукты в специальных аппаратах, которые называют реакторами. При этом протекают следующие процессы:
-
химические - разрушение связей и образование новых;
-
массообменные (диффузионные) – движение молекул внутри фаз и через границу раздела фаз;
-
гидродинамические – перемещение потоков внутри реактора;
-
тепловые – теплообмен между отдельными частями реакционной смеси или между реакционной смесью и окружающей средой.
Три последние группы процессов являются физическими, они сопровождают химический процесс, оказывая в той или иной степени влияние на эффективность протекания всего ХТП в целом.
Упрощая задачу, рассмотрим сначала только химические процессы, то есть непосредственно химические реакции, лежащие в основе ХТП, и найдем закономерности управления ими.
В основе ХТП могут лежать разные реакции. Используем метод моделирования и сведем все многообразие химических реакций к нескольким достаточно простым моделям и для каждой модели определим критерий эффективности протекания этой реакции и зависимость этого критерия от технологических параметров.
Технологическая классификация химических процессов (модели реакций)
Разработка любой химической технологии начинается с технологической классификации химического процесса, то есть с определения основных признаков, определяющих выбор объектов и инструментов его управления, конструкции реактора и т.д.
Существует ряд признаков, по которым можно классифицировать химические процессы.
-
Процессы могут быть простые и сложные.
Простые процессы описываются одним стехиометрическим уравнением.
А → С или А + В → С + D
В сложных процессах наряду с целевой реакцией протекают побочные реакции, и для описания процесса требуется несколько уравнений.
Сложные процессы могут быть:
- последовательные (консекутивные) А + В → R
R → S
- параллельные А + В → R
А + C → S
- смешанные А + В → R
А + R→ S
2) Процессы могут быть необратимые и обратимые.
Обратимые процессы в отличие от необратимых протекают одновременно в прямом и обратном направлении.
3) Процессы могут быть экзо- и эндотермические, то есть протекать соответственно, с выделением или поглощением тепла. Различают также процессы с большим тепловым эффектом и процессы с малым тепловым эффектом.
4) Процессы могут быть гомогенные и гетерогенные. В первом случае все участники реакции находятся в одной фазе; во втором - одной из стадий процесса является переход через границу раздела фаз.
5) Процессы бывают каталитические и некаталитические.
Совершенно очевидно, что каждая конкретный процесс обладает признаками разных классов. Например, процесс синтеза аммиака
N2 (г) + 3 H2 (г) ↔ NH3 (г), ∆Н < 0
является простым, обратимым, экзотермическим, каталитическим (катализатор – металлическое железо), гомофазным, но гетерогенным, так как газообразные реагенты взаимодействуют между собой на поверхности твердого катализатора.
Закономерности управления простым необратимым гомогенным процессом
Характеристика модели:
1) Процесс простой – можно описать одним стехиометрическим уравнением
аА + bВ → cС + dD, где С – целевой продукт;
β = α, так как весь реагент превращается только в целевой продукт.
2) Процесс необратимый – αmax = 100%.
Величина конверсии реагента изменяется во времени α = f (τ), стремясь к максимальной величине 100%, так как текущая концентрация реагента «С» уменьшается во времени, стремясь к нулю. 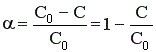
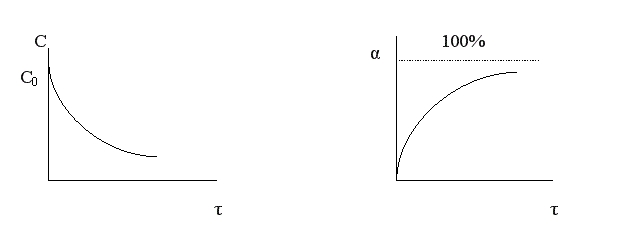
Чем меньше время достижения 100%-ной конверсии, тем эффективнее протекает реакция. То есть эффективность зависит от скорости химической реакции r .
-
Процесс гомогенный – скорость процесса равна скорости химической реакции.
На основе приведенной характеристики модели видно, что эффективность проведения простого необратимого гомогенного процесса определяется величиной скорости химической реакции, то есть единственным объектом управления является скорость химической реакции.
Инструментами управления простым необратимым гомогенным процессом являются те технологические параметры, которые влияют на скорость химической реакции, то есть температура, давление, концентрация реагента, природа и концентрация катализатора.
r = f (t, p, C, kat)
1) Влияние концентрации
Зависимость скорости химической реакции от концентрации реагентов выражается законом действующих масс:
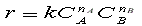 ,
,
где k – константа скорости, СА и СВ – текущие концентрации реагентов, nA и nB - порядок реакции по реагенту А и В соответственно.
Анализ уравнения закона действующих масс приводит к выводу, что:
1) скорость химической реакции увеличивается при увеличении концентрации реагентов;
2) скорость реакции в большей степени зависит от концентрации того реагента, порядок по которому выше;
3) скорость химической реакции уменьшается во времени, так как уменьшаются текущие концентрации реагирующих веществ.
Из уравнения закона действующих масс вытекает возможность использования двух технологических приемов, позволяющих увеличить скорость химической реакции:
-
работа с более концентрированным сырьем; при необходимости сырье предварительно обогащают, то есть тем или иным способом увеличивают в нем содержание основного компонента;
-
использование избытка одного из реагентов; что позволяет сохранять в ходе реакции высокие значения произведения
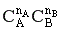 , а, следовательно, и высокую скорость процесса.
, а, следовательно, и высокую скорость процесса.
В избытке берется тот реагент:
- порядок по которому выше;
- стоимость которого ниже;
- отделение которого от продуктов проще.
Избыток не должен сильно разбавлять реакционную смесь, нарушать теплофизические свойства реакционной смеси и тепловое регулирование реактора. Кроме того, слишком большой избыток реагента приводит к лишним экономическим затратам. Величину избытка определяют экспериментально; обычно берут избыток реагента 1,7 – 1,8 по сравнению со стехиометрией.
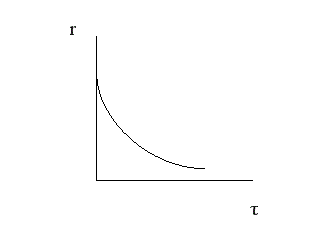
Вполне очевидно, что, чем выше скорость химической реакции, тем меньше время достижения одной и той же величины конверсии.
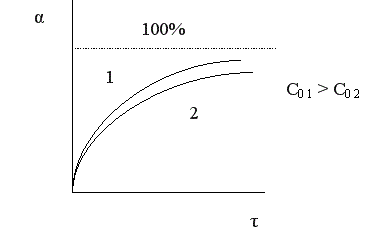
Поэтому при больших начальных, а, следовательно, и текущих концентрациях реагента время проведения химической реакции уменьшается.
Анализ кривой α = f (τ) также показывает, что скорость изменения конверсии уменьшается во времени, и при значениях α, близких к 100%, изменение конверсии очень незначительно. Поэтому всегда существует некоторое оптимальное значение конверсии (обычно 80-90%), при достижении которого вести процесс дальше экономически нецелесообразно. Время достижения этой величины конверсии называют оптимальным временем реакции τопт..
-
Влияние давления
Скорость реакции зависит от числа столкновений реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше).
В случае газофазных реакций концентрации реагентов в кинетическом уравнении можно заменить их парциальными давлениями.
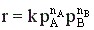
Известно, что парциальные давления компонентов смеси пропорциональны их мольным долям.
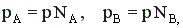
где р – общее давление, NA и NB – мольные доли компонентов А и В.
Тогда 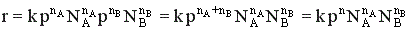 , где n = nA + nB.
, где n = nA + nB.
То есть скорость газофазной реакции пропорциональна давлению в степени, равной порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка.
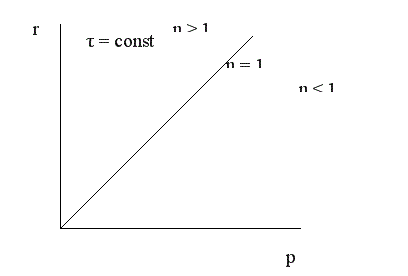
Зависимость конверсии от давления при τ = const имеет следующий вид:
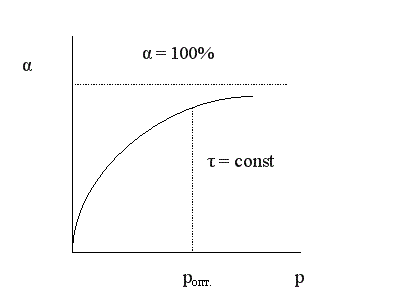
При увеличении давления конверсия увеличивается. Однако повышение давления имеет предел; выше некоторого оптимального значения давления ропт. увеличение его приводит к незначительному увеличению конверсии и выхода целевого продукта и поэтому становится нецелесообразным.
На практике использование давления в качестве фактора управления химической реакцией ограничено большими затратами на его реализацию и возможностями техники высокого давления.
-
Влияние температуры
Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры.
Скорость химической реакции возрастает при увеличении температуры на 100 в 2 - 4 раза. Это эмпирическое правило называется правилом Вант-Гоффа. Оно справедливо в области средних температур (до 4000С).
Более точно влияние температуры можно описать уравнением Аррениуса: 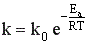 ,
,
где Еа – энергия активации, Т – температура, R – газовая постоянная, k0 – предэкспоненциальный множитель, зависящий только от природы реагирующих частиц.
Подставим это уравнение в уравнение закона действующих масс

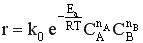
и увидим, что скорость химической реакции при увеличении температуры возрастает по экспоненте. Степень влияния температуры зависит от величины энергии активации. Реакции с большей энергией активации более чувствительны к изменению температуры, реакции с малой энергией активации нечувствительны.
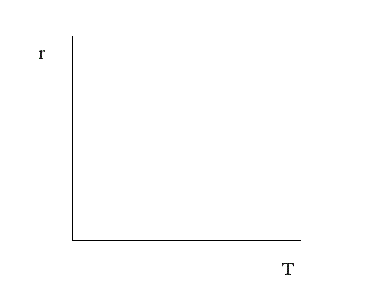
Каждая реакция значительно более чувствительна к изменению температуры при низких температурах, чем при высоких.
Установим зависимость конверсии от температуры. Эта зависимость носит S-образный характер.
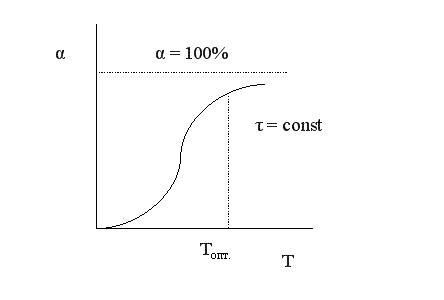
При низких температурах мала скорость процесса, поэтому невелик подъем кривой α = f (T). По мере повышения температуры скорость реакции увеличивается по экспоненте, что приводит к резкому подъему кривой. Но с увеличением степени превращения реагентов снижается их концентрация, а, следовательно, и скорость процесса, поэтому функциональная зависимость α = f (T) асимптотически приближается к единице.
Анализ кривой на графике приводит к выводу, что в данном случае тоже существует некоторое оптимальное значение задаваемого параметра – температуры, выше которого вести процесс экономически нецелесообразно из-за незначительного увеличения конверсии при высоких энергетических затратах.
Термический способ активации химической реакции очень часто используется в технологии (до 95% от общего числа промышленных синтезов). Недостатком этого способа является высокие энергетические затраты и низкая селективность (при повышении температуры ускоряются не только целевые реакции, но и побочные).
Обобщая вышесказанное, можно сделать вывод, что в случае простого необратимого гомогенного процесса конверсия реагентов и выход целевого продукта изменяются синхронно и стремятся к 100% с увеличением времени нахождения реагентов в зоне реакции. Время достижения нужного значения конверсии можно сократить, увеличивая скорость химической реакции. Таким образом, эффективность такого процесса определяется только величиной скорости химической реакции.
Для увеличения скорости реакции используют следующие технологические приемы:
-
работа с высококонцентрированным сырьем;
-
использование избытка одного из реагентов;
-
использование оптимального давления в случае газофазных реакций;
-
активация реакции тем или иным способом, например, повышением температуры.
Однако следует помнить, что в технологической практике иногда избегают излишнего повышения скорости реакции. Обычно это связано с трудностями быстрого теплоотвода в случае сильноэкзотермических реакций. В таких процессах используют малоконцентрированное сырье или даже разбавляют реакционную массу, например, введением растворителя или инертного газа.
Пример: Получение соляной кислоты
Соляная кислота – это водный раствор хлористого водорода.
Ранее соляную кислоту получали из поваренной соли действием на нее серной кислоты NaCl(т) + H2SO4 (конц.) → Na2SO4 (т) + HCl (г)↑
с последующим растворением образующегося газообразного хлороводорода в воде. Полученная таким образом кислота имела низкую концентрацию (22 – 26% масс.) и большое количество примесей.
В настоящее время для получения соляной кислоты применяют синтетический хлористый водород и так называемый абгазный HCl, являющийся побочным продуктом при хлорировании органических веществ.
Производство синтетической соляной кислоты состоит из двух стадий: синтеза хлористого водорода и его абсорбции водой. В основе синтеза HCl лежит реакция: Н2 (г) + Cl2 (г) → 2 HCl(г), ∆Н = -183,7 кДж/моль.
Технологическая классификация процесса: простой, необратимый, гомофазный и гомогенный, экзотермический процесс. Реакция протекает по радикальному механизму и ускоряется при нагревании, световом облучении или в присутствии катализатора. В определенных условиях взаимодействие водорода с хлором протекает со взрывом.
Объект управления – скорость химической реакции.
Синтетический HCl получают путем сжигания водорода в атмосфере хлора в печи, состоящей из двух соединенных основаниями усеченных конусов с диаметром в основании до 2 м. Общая высота печи равна 5,2 м. В днище печи установлена горелка, в которую непрерывно подают хлор и водород. Горелка состоит из двух трубок, вмонтированных в стальной патрон. Хлор поступает по внутренней трубке, водород – по наружной. Устройство горелки позволяет хорошо перемешивать реагенты, что предотвращает возможность взрыва.
Для поддержания оптимальной скорости процесса при синтезе HCl используют высокую температуру: факел пламени сгорающих газов имеет температуру около 20000С и понижается по высоте печи до 800 – 12000С. Такая высокая температура обусловлена сильным выделением тепла при взаимодействии реагентов; это позволяет вести процесс без применения катализаторов. Давление в печи около 80 кПа (~0,8 атм).
Для получения HCl используют газообразный хлор, содержащий не менее 75% Cl2, и 95%-ный Н2. Количество подаваемого в систему водорода таково, чтобы его содержание в отходящем газе было на 5 – 10% больше содержания хлора во избежание создания взрывоопасной концентрации. Избыток водорода позволяет также поддерживать высокую скорость процесса и 100%-ную конверсию хлора. Процесс синтеза контролируют по цвету пламени: при нормальной работе он должен быть молочно-белый, при увеличении содержания хлора пламя приобретает зеленоватый оттенок.
На рисунке приведена технологическая схема производства соляной кислоты. Хлор и водород автоматически дозируются по показаниям дифференциальных манометров, установленных на газопроводах, ведущих к печи. При необходимости они проходят систему предварительной очистки, непоказанную на схеме. Газ на выходе из печи имеет температуру 350 – 4500С; его охлаждают в газовом холодильнике и передают на абсорбцию. Процесс абсорбции осуществляется в адиабатических условиях, то есть без отвода тепла (способ Гаспаряна). При растворении HCl в воде происходит выделение большого количества тепла, которое расходуется на испарение воды; при этом происходит повышение концентрации кислоты. Синтетическая соляная кислота имеет концентрацию 31 – 33 % масс. Абсорбционная колонна выполнена из фаолита и снабжена насадкой из колец Рашига размером 25×25×3 мм. На поверхности этой насадки происходит контактирование газообразного HCl с водой. Температура абсорбции 82 – 850С, она регулируется за счет испарения воды.
Непоглощенные газы, содержащие водород, азот, HCl и пары воды, из верхней части колонны поступают в хвостовую башню. Башня заполнена насадкой из колец Рашига и орошается водой. Здесь происходит окончательное поглощение хлористого водорода, конденсируются пары воды, а оставшийся водород и инертные газы выбрасываются в атмосферу через эжектор и огневзрывопреградитель. Кислую воду из хвостовой башни после нейтрализации сбрасывают в канализацию.
Пример: Технология получения серной кислоты. Получение обжигового газа из серы.
Традиционно основными источниками сырья для получения серной кислоты являются сера и железный (серный) колчедан. Около половины серной кислоты в России получают из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы. Однако из-за низкой концентрации SO2 в таких отходящих газах их переработка пока еще не всегда осуществима. Например, в 1980 г. потеряно SO2 с отходящими газами (в пересчете на серу) 100 млн. т., в то время как мировое потребление серы составляло лишь 65 млн. т. Отходящие газы – наиболее дешевое сырье, низка стоимость колчедана, наиболее дорогостоящим сырьем является сера.
Получение серной кислоты включает несколько этапов. Первым этапом является получение диоксида серы окислением (обжигом) серосодержащего сырья. Следующий этап – превращение SO2 в SO3. В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты:
- контактный, при котором окисление проводят на твердых катализаторах, а затем образующийся оксид серы (VI) поглощают водой
SO3 + H2O → H2SO4;
- нитрозный (башенный), при котором окисление проводят в жидкой фазе оксидами азота SO2 + N2O3 + H2O → H2SO4 + 2NO.
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
При сжигании серы протекает реакция S + O2 → SO2.
Технологическая классификация процесса: простой, необратимый, газофазный и гомогенный, сильно экзотермический процесс.
Объект управления - скорость химической реакции.
Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют; для этого используют водяной пар, полученный при утилизации теплоты основной реакции горения серы. Затем серу отфильтровывают от примесей, получая исходное сырье достаточной степени чистоты, и подают в печь, Для сжигания используют два типа печей – форсуночные и циклонные. В них предусмотрено распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата. Из печи обжиговый газ поступает в котел-утилизатор, где отдает свое тепло, и далее в последующие аппараты технологической схемы.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составляет ~15000С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 13000С быстро разрушается футеровка печи и газоходов.
Воздух обычно берут в избытке по сравнению со стехиометрическим количеством. В противном случае в печи будет слишком высокая температура. Слишком большой избыток воздуха приводит к снижению концентрации диоксида серы в обжиговом газе.