Лекция № 14. Теплоперенос в химических реакторах
Температура оказывает существенное влияние на скорость химического процесса и другие показатели его эффективности. При проведении реакций разного типа требуется различный температурный режим. Под температурным режимом реактора понимают поддержание в нем необходимой и оптимальной для данного процесса температуры. В промышленной практике используют два типа температурного режима:
-
режим постоянных температур
-
режим переменных температур.
Выбор режима определяется, в основном, технологическим классом реакции.
|
Тип реакции
|
Критерии эффективности процесса
|
Температурный режим
|
|
1. Простая необратимая реакция
|
скорость реакции
при Т↑ r↑
|
постоянная максимально оптимальная температура или повышающийся температурный режим
|
|
2. Простая обратимая реакция
а) эндотермическая или слабо экзотермическая
б) сильно экзотермическая
|
скорость реакции, положение равновесия
при Т↑ r↑, α*↑
при Т↑ r↑, α*↓
|
постоянная максимально оптимальная температура
понижающийся температурный режим
|
|
3. Сложные реакции
а) Еа цел.р. = Еа побоч..р.
б) Еа цел.р. >Еа побоч..р.
в) Еа цел.р. < Еа побоч..р.
|
скорость реакции, селективность
при Т↑ r↑, S=const
при Т↑ r↑, S↑
при Т↑ r↑, S↓
|
постоянная максимально оптимальная температура
постоянная максимально оптимальная температура
постоянная минимально оптимальная температура
|
Температура в реакторе может изменяться по двум причинам:
-
за счет протекания химической реакции (если реакция экзотермическая, температура повышается, если эндотермическая – понижается);
-
за счет теплообмена с окружающей средой, то есть температура в реакторе зависит от теплового режима реактора.
По тепловому режиму выделяют три модели реакторов: адиабатический, изотермический и политропический.
Учет всех тепловых явлений осуществляется при составлении теплового баланса реактора, уравнение которого, наряду с уравнением материального баланса, является основой для расчета реакторов.
Уравнение теплового баланса реактора
В общем виде уравнение теплового баланса записывается
Qприход = Qрасход,
где Qприход – количество тепла, поступающего в реактор в единицу времени, Qрасход – количество тепла, расходуемого в реакторе в единицу времени.
Тепло приходит в реактор с реагентами Qреаг. и выделяется (или поглощается) в результате химической реакции Qхим.р.
Qприход = Qреаг. ± Qхим.р.
Расход тепла происходит в результате уноса тепла с продуктами Qпрод., теплообмена с окружающей средой Qт/об.; часть тепла накапливается в реакторе Qнакоп..
Qрасход = Qпрод. ± Qт/об. + Qнакоп.
Qреаг. ± Qхим.р.= Qпрод. ± Qт/об. + Qнакоп.
Обозначим Qпрод.- Qреаг. = Qконв. – конвективный перенос тепла.
Тогда после преобразований получим
Qнакоп. = - Qконв. ± Qт/об. ± Qхим.р. - уравнение теплового баланса реактора в общем виде.
Если температура неодинакова в разных точках объема реактора или во времени, используют дифференциальную форму уравнения теплового баланса, выведенную для некоторого элементарного объема dx dy dz.
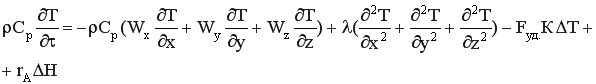
где ρ – плотность реакционной смеси; Ср – удельная теплоемкость реакционной смеси; x,y,z – пространственные координаты, Wx, Wy, Wz - составляющие скорости движения потока в направлении осей x,y,z; λ – коэффициент молекулярной и турбулентной теплопроводности реакционной смеси; Fуд. – удельная поверхность теплообмена; К – коэффициент теплопередачи; ∆Т = Т – Тт/нос. ( Т – температура реакционной смеси, Тт/нос. – температура теплоносителя); rA - скорость химической реакции; ∆Н – тепловой эффект реакции.
Решение дифференциального уравнения связано с большими трудностями. Однако в каждом конкретном случае его можно упростить. Например, при стационарном режиме в проточных реакторах Qнакоп. = 0, для периодических реакторов отсутствует конвективный перенос тепла Qконв. = 0.
Выведем уравнения теплового баланса для различных гидродинамических и тепловых моделей реакторов.
1.Политропический режим
а) РИС-П
В периодическом реакторе нет конвективного переноса тепла, то есть 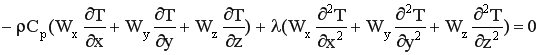
Тогда уравнение теплового баланса приобретает вид
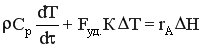
Проведем некоторые преобразования.
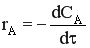 CA = CA0 (1-αA)
CA = CA0 (1-αA) 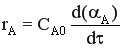
После подстановки получим
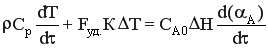
Умножив уравнение на dτ и разделив на СА0, получим
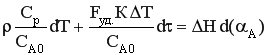
Обозначим 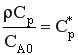 - мольная теплоемкость реакционной смеси.
- мольная теплоемкость реакционной смеси.
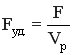 , где Vp –объем реактора, F–общая поверхность теплообмена.
, где Vp –объем реактора, F–общая поверхность теплообмена.
СА0 Vp = NA0 – мольный расход реагента А (количество кмоль реагента А, загруженного в реактор).
Тогда 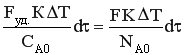
В результате проведенных преобразований получаем уравнение теплового баланса РИС-П в политропическом режиме в следующем виде
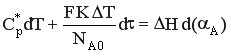
б) РИВ-Н
Тепловые процессы в РИВ-Н описываются дифференциальной формой теплового баланса при условии, что в реакторе не происходит накопление тепла (стационарный режим), а конвективный перенос тепла происходит исключительно по длине реактора.
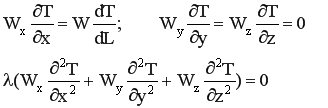
При таких условиях уравнение теплового баланса имеет вид
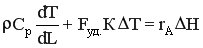
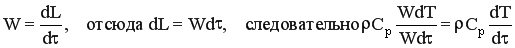
Ранее было выведено, что 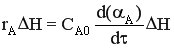 . Тогда
. Тогда
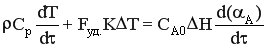
Разделим уравнение на СА0 и умножим на dτ.
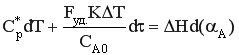 ,
,
где 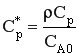 .
.
Проведем некоторые преобразования:
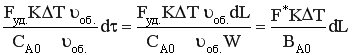 ,
,
где 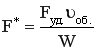 - поверхность теплообмена, приходящаяся на 1 м длины реактора, dL – длина элемента реактора,
- поверхность теплообмена, приходящаяся на 1 м длины реактора, dL – длина элемента реактора, 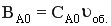 - мольный расход реагента (мольная скорость, моль/час).
- мольный расход реагента (мольная скорость, моль/час).
Итак, уравнение теплового баланса РИВ-Н в политропическом режиме имеет вид 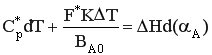
в) РИС-Н
Этот реактор работает в стационарном режиме, для него характерно отсутствие градиента параметров как во времени, так и по объему реактора. Поэтому уравнение теплового баланса, так же как и уравнение материального баланса, составляют сразу для всего реактора в целом.
Qнакопл. = -Qконвек. – Qт/об. + Qхим.р.
Qнакопл. = 0, Qхим.р = Qконвек. + Qт/об.
Qхим.р = rA ΔH Vp = 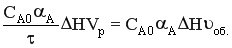 , т.к. Vp = υоб.τ.
, т.к. Vp = υоб.τ.
Qконвек. = ρ Ср υоб. (Т – Т0), где Т0 – температура на входе в реактор.
Qт/об. = F K ΔT.
Тогда ρ Ср υоб. (Т – Т0) + F K ΔT = СА0 αА ΔH υоб..
Разделим уравнение на СА0 υоб. = ВА0.
Получим уравнение теплового баланса РИС-Н в политропическом режиме 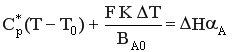
2. Адиабатический режим
Qт/об. = 0
РИС-П Ср* dT = H d(A)
РИВ-Н Ср* dT = H d(A)
РИС-Н Ср* (T – Т0) = H A
3.Изотермический режим
T = const, T = T0
РИВ-Н 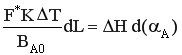
РИС-Н 
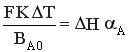
В адиабатическом режиме для РИС-Н Ср* (T – Т0) = H A.
Отсюда Т – Т0 = 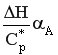 .
.
Обозначим 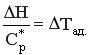 - адиабатическая разность температур.
- адиабатическая разность температур.
Тогда Т = Т0 Тад.А
Знак - соответствует эндотермической реакции, знак + - экзотермической реакции.
Такую же зависимость можно вывести для РИВ-Н в адиабатическом режиме. Ср* dT = H d(A)
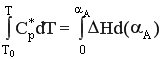
Пусть Ср* и H не зависят от температуры, тогда Ср* (T – Т0) = H A.
Т = Т0 Тад.А.
Это уравнение показывает, что между степенью превращения реагента и изменением температуры существует линейная зависимость. Поэтому в адиабатическом реакторе в любой момент времени (для определенной величины конверсии) можно рассчитать температуру реакционной смеси.
Устойчивость режима работы реактора
Ни один реактор не работает в строго стационарном режиме. Небольшие колебания состава исходных реагентов, температуры, давления, скорости потоков и другие возмущения могут вывести процесс из стационарного состояния. Химико-технологический процесс протекает нормально только в том случае, если малые внешние воздействия ведут к малым отклонениям от режима процесса и после снятия произведенного возмущения система может возвратиться к прежнему состоянию. Такая система называется устойчивой.
В неустойчивой системе отклонение, вызванное случайным возмущением на входе в реактор, увеличивается во времени; режим после снятия возмущения не возвращается в исходное стационарное состояние.
Единственной причиной неустойчивости химических процессов является температурная неустойчивость, то есть самоускорение или самозамедление реакции под воздействием изменения собственного теплового эффекта. Причина заключается в различной зависимости скорости тепловыделения и скорости теплоотвода. При любом изменении технологического параметра происходит изменение скорости химической реакции, а значит, меняется скорость выделения или поглощения тепла. Скорость же теплоотвода или теплоподвода остается постоянной. Нарушается баланс между приходом и расходом тепла в реакторе (тепловой баланс). Следствием этого является нарушение стационарности процесса в проточном реакторе. Если произведенное нарушение режима приводит к увеличению разницы между приходом и расходом тепла, система уже не может вернуться в исходное стационарное состояние.
Условия стационарности находят при совместном решении уравнений материального и теплового балансов. Решение уравнений заключается в определении параметров процесса, при которых соблюдается равенство между приходом и расходом тепла при оптимальных показателях технологического процесса. Для этой цели часто используют графический метод.
Чтобы воспользоваться этим методом для РИВ-Н необходимо дифференциальные уравнения теплового и материального балансов, составленные для элементарного объема, проинтегрировать в пределах изменения параметров, что в большинстве случаев, представляет значительную трудность. Для РИС-Н материальный и тепловой балансы составляются в виде простых, легко решаемых уравнений. Поэтому рассмотрим графический метод определения условий стационарности на примере РИС-Н.
-
Адиабатический режим
а) Простая необратимая экзотермическая реакция А С, Н 0